在公共卫生领域,一次性使用病毒采样管、采样器作为关键的医疗器械,其生产、销售和使用需严格遵守国家医疗器械监督管理规定。随着科技发展,部分与采样配套的电子产品(如智能采样信息管理终端、温度监测设备等)也可能被纳入医疗器械管理范畴。本文将系统解析这两类产品办理医疗器械产品备案(通常指第一类医疗器械备案)的完整流程与要点。
一、 核心概念与分类界定
- 产品定义:
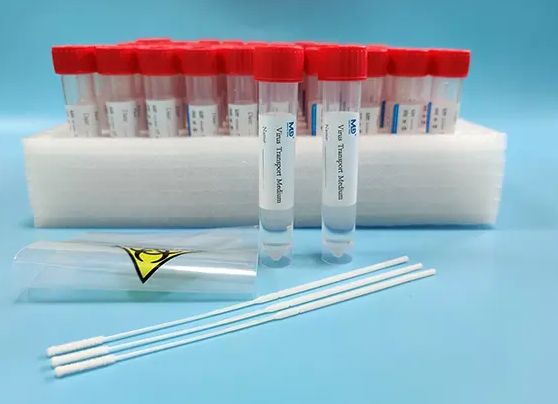
- 一次性使用病毒采样管/采样器:用于采集人体样本(如咽拭子、鼻拭子)并保存运输,通常包含拭子、保存液及容器。属于《医疗器械分类目录》中“临床检验器械”或“医用耗材”范畴。
- 相关电子产品:若产品预期用途与疾病诊断、监测直接相关(如专用于样本信息绑定、追踪、温控监测的设备),可能被判定为医疗器械。需根据《医疗器械分类规则》进行具体界定。
- 管理类别判定:
- 大多数常规的一次性病毒采样管、采样器属于第一类医疗器械(风险程度低)。
- 若采样管含有特殊保存液(如灭活型),或电子产品具有复杂诊断功能,则可能被归为第二类。本文主要聚焦于第一类产品的备案流程。关键步骤是依据《医疗器械分类目录》及国家标准,准确确定产品分类编码和管理类别。
二、 备案前准备:主体资质与产品要求
- 备案主体资格:申请人必须是持有《营业执照》的企业,且经营范围应包含医疗器械生产、销售等相关内容。
- 产品技术研究:完成产品设计开发、验证,确保符合强制性国家标准(如GB/T 14233.1等)及行业标准。
- 生产条件准备:具备与产品生产相适应的场地、设备、人员及质量管理体系(虽一类备案不强制体系认证,但需具备基本质量管控能力)。
三、 第一类医疗器械产品备案核心流程
第一步:产品检验
委托具有资质的医疗器械检验机构,依据产品技术要求进行全性能检验,取得合格的《产品检验报告》。
第二步:准备备案材料
主要材料清单如下:
- 第一类医疗器械产品备案表。
- 产品风险分析报告。
- 产品技术要求(明确性能指标、检验方法)。
- 产品检验报告。
- 临床评价资料(一类产品通常可通过免临床目录、同品种对比等方式完成)。
- 产品说明书及最小销售单元标签设计样稿。
- 生产制造信息(工艺简述、场地等)。
- 证明性文件(营业执照副本、法人身份证复印件等)。
- 符合性声明(声明材料真实、产品合规)。
对于电子产品,还需提供软件描述文档(若含软件)、电气安全与电磁兼容性检测报告等。
第三步:在线提交与窗口报送
通过国家药品监督管理局“医疗器械注册管理信息系统”在线填报并提交电子资料。按所在地省级药品监督管理部门要求,报送纸质资料。
第四步:主管部门审核与备案凭证发放
药品监督管理部门对资料进行形式审查,符合要求的,予以备案,当场发放《第一类医疗器械产品备案凭证》。不符合要求的,将一次性告知需补正内容。
第五步:生产备案衔接
取得产品备案凭证后,生产企业还需向所在地设区的市级药监部门办理第一类医疗器械生产备案,获取《医疗器械生产备案凭证》,方可进行生产。
四、 特别注意事项
- 分类准确性:务必确保产品分类正确。分类错误可能导致备案无效甚至面临处罚。
- 材料真实性:所有提交材料必须真实、准确、完整。虚假备案将承担法律责任。
- 动态更新:备案信息(如产品名称、技术要求、说明书等)发生变更时,需及时办理备案变更。
- 电子产品特殊性:集成软件的电子设备,其软件安全性、数据合规性(如隐私保护)需重点评估并体现在技术文件中。
- 法规更新关注:密切关注国家药监局及标准委发布的最新法规、标准及分类目录动态,确保持续合规。
五、 建议
办理一次性使用病毒采样管、采样器及相关电子产品的医疗器械备案,是一项专业、系统的合规工作。企业应:
- 先行论证:清晰界定产品属性和管理类别。
- 精心准备:组建专业团队或寻求合规咨询机构协助,高质量准备备案资料。
- 规范流程:严格按照“产品检验→准备材料→提交备案→生产备案”的步骤推进。
- 体系保障:即便是一类产品,也应建立并运行基本的质量管理体系,确保产品安全有效。
通过完整、规范的备案流程,企业不仅能顺利将产品推向市场,更能为公共卫生事业提供安全、可靠的技术产品保障。